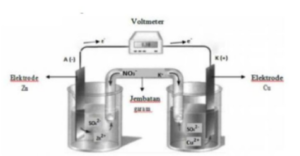
Perhatikan gambar berikut!
Reaksi total dari sel volta tersebut yang tepat adalah….
A. Cu2+ (aq) + Zn (s) → Cu(s) + Zn2+ (aq)
B. Cu (s) + Zn2+ (aq) → Cu2+ (aq) + Zn (s)
C. 2Cu2+ (aq) + Zn (s) → 2Cu (s) + Zn2+ (aq)
D. 2Cu (s) + Zn2+ (aq) → 2 Cu2+ (aq) + Zn (s)
E. Cu (s) + 3 Zn2+ (aq) → Cu2+ (aq) + 3 Zn (s)
Jawabannya adalah A. Cu^2+(aq) + Zn(s) → Cu(s) + Zn^2+(aq)
Untuk lebih jelasnya, yuk simak pembahasan berikut ini.
Sel volta adalah sel elektrokimia yang dapat menghasilkan energi listrik, hal itu disebabkan oleh terjadinya reaksi redoks yang spontan.
Pada sel volta, reaksi reduksi terjadi pada katoda sedangkan reaksi oksidasi terjadi pada anoda.
Pada sel volta diatas, logam Zn bertindak sebagai anoda sedangkan logam Cu bertindak sebagai katoda. Hal ini karena logam Cu memiliki nilai potensial reduksi yang lebih besar (lebih positif) daripada potensial reduksi logam Zn. Selain itu, elektron juga mengalir dari Zn ke Cu. Pada sel volta, elektron mengalir dari anoda ke katoda. Reaksi yang terjadi adalah
Katoda: Cu^2+(aq) + 2e —-> Cu(s)
Anoda: Zn(s) —-> Zn^2+(aq) + 2e
Karena jumlah elektronnya sudah setara, maka reaksi totalnya adalah
Cu^2+(aq) + Zn(s) → Cu(s) + Zn^2+(aq)
Jadi, reaksi totalnya adalah
Cu^2+(aq) + Zn(s) → Cu(s) + Zn^2+(aq)
 IlmuanTekno Berita tentang Gadget, Teknologi, Trading, Forex, Saham, Investasi, Bisnis, dan Info Keuangan.
IlmuanTekno Berita tentang Gadget, Teknologi, Trading, Forex, Saham, Investasi, Bisnis, dan Info Keuangan.